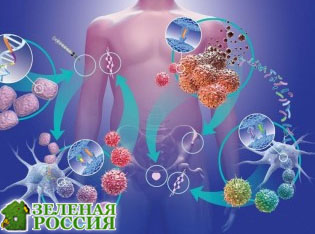
Исследователи из Онкологического центра имени Киммела при Университете Джона Хопкинса и Института онкологической иммунной терапии Bloomberg-Kimmel разработали компьютерную модель, которая помогает ученым идентифицировать иммунные клетки, борющиеся с опухолью, у пациентов с раком легких, получающих терапию ингибиторами иммунных контрольных точек.
В своем исследовании, опубликованном 3 февраля в журнале Nature Communications, команда, включая первого автора Жена Цзэна, доктора философии, младшего научного сотрудника по биоинформатике в Онкологическом центре Киммела, продемонстрировала, что их трехгенная компьютерная модель «MANAscore» может идентифицировать иммунные клетки, на которые нацелены терапии ингибиторами иммунных контрольных точек. Модель также помогла команде выявить различия, связанные с ответом пациента на иммунотерапию.
«Мы разработали способ идентификации клеток, на которые непосредственно нацелены ингибиторы иммунных контрольных точек, и если мы можем их выявить, то можем их изучать», — говорит старший автор исследования, Келли Смит, доктор философии, доцент онкологии в Университете Джона Хопкинса. «Если мы можем их изучать, это означает, что мы можем идентифицировать лучшие биомаркеры и цели для комбинированной иммунотерапии».
Ингибиторы иммунных контрольных точек, такие как ингибиторы PD-1, доступны для лечения десятков видов рака. Эти революционные терапии работают, высвобождая клетки, уничтожающие опухоли, называемые Т-клетками, которые блокируются белком PD-1.
Ингибиторы PD-1 активируют Т-клетки пациента, позволяя иммунной системе более эффективно бороться с раком. Однако не все пациенты реагируют на эти терапии, и ученым необходимо понять, почему это происходит, чтобы разработать улучшенные методы лечения для тех, кто не отвечает на терапию.
«Т-клетки, активные против опухоли, имеют решающее значение для ответа пациента на терапию, но их трудно найти», — говорит Цзэн.
Смит помогла разработать технологию MANAFEST (Mutation-Associated NeoAntigen Functional Expansion of Specific T Cells), которую она и коллеги впервые описали в журнале Cancer Immunology Research в 2018 году.
Их подход сочетал MANAFEST с секвенированием на уровне отдельных клеток для выявления этих редких иммунных клеток у шести пациентов с раком легких — трудоемкий процесс, который занял несколько лет и стоил миллионы долларов.
Первоначальное исследование показало, что иммунные клетки, активированные иммунотерапией, имеют общую экспрессию генов. В новом исследовании Цзэн, Смит и их коллеги продолжили эти открытия, разработав модель MANAscore.
«Наша модель позволяет нам пропустить трудоемкий и дорогой процесс для идентификации клеток, на которые нацелена иммунотерапия, и поможет нам определить, что отличает тех, кто отреагирует на эти терапии», — говорит Смит. «Мы не первые, кто разработал такую модель, но наша отличается тем, что она использует только три гена, в то время как наиболее часто используемая модель требует более 200 генов. Наша проще и удобнее».
Команда также обнаружила ключевые различия в Т-клетках, активированных в опухолях пациентов, которые ответили на терапию ингибиторами иммунных контрольных точек, по сравнению с теми, кто не ответил. У пациентов, которые ответили на терапию, наблюдается более высокая доля Т-клеток, напоминающих стволовые, которые служат резервуаром для новых клеток и могут развиваться в эффективные клетки, борющиеся с опухолью, говорит Цзэн.
Это наблюдение может помочь объяснить, почему пациенты более эффективно реагируют; стволоподобные характеристики могут облегчить размножение Т-клеток в армию клеток, борющихся с опухолью. Необходимы дополнительные исследования для подтверждения этих наблюдений.
«Стволоподобные характеристики Т-клеток критичны, потому что они позволяют клеткам обновляться и сохраняться на длительный срок», — говорит Цзэн. «Это обеспечивает поддержание иммунного ответа и способность расширяться в сильную популяцию эффекторных Т-клеток при необходимости».
Тем временем команда работает над разработкой клинического теста, использующего мультиспектральные панели иммунофлуоресценции для идентификации трехгенной подписи Т-клеток, реагирующих на иммунотерапию.
«Мы надеемся перевести нашу трехгенную подпись в биомаркер, который клиницисты смогут использовать для ведения лечения рака», — говорит Смит.
Цзэн также использует свою новую модель для того, чтобы выяснить, помогает ли близость Т-клеток с трехгенной подписью к другим типам иммунных клеток, таким как регуляторные Т-клетки, контролировать иммунный ответ.
«Мы хотим применить нашу модель к пространственным данным, чтобы понять, влияют ли взаимодействия между Т-клетками, нацеленными на опухоль, и другими типами клеток на клинические результаты», — говорит Цзэн.
Она также сотрудничает с другими лабораториями по всей стране, чтобы выяснить, можно ли использовать MANAscore у пациентов с различными типами рака. Они создали базу данных с данными секвенирования отдельных клеток по различным типам рака и будут использовать этот показатель для выявления характеристик Т-клеток-ответчиков, специфичных для различных видов рака.




 Исследователи из Онкологического центра имени Киммела при Университете Джона Хопкинса и Института онкологической иммунной терапии Bloomberg-Kimmel разработали компьютерную модель, которая помогает ученым идентифицировать иммунные клетки, борющиеся с опухолью, у пациентов с раком легких, получающих терапию ингибиторами иммунных контрольных точек.
Исследователи из Онкологического центра имени Киммела при Университете Джона Хопкинса и Института онкологической иммунной терапии Bloomberg-Kimmel разработали компьютерную модель, которая помогает ученым идентифицировать иммунные клетки, борющиеся с опухолью, у пациентов с раком легких, получающих терапию ингибиторами иммунных контрольных точек.


 В соответствии с результатами недавних исследований, проведенных биологами, на планете растет три триллиона деревьев. Данные официальны. ...
В соответствии с результатами недавних исследований, проведенных биологами, на планете растет три триллиона деревьев. Данные официальны. ... Американские ученые выдвинули мнение относительно лучшего возраста для мужчин, желающих примерить статус родителя. Авторами ...
Американские ученые выдвинули мнение относительно лучшего возраста для мужчин, желающих примерить статус родителя. Авторами ... Очередное мнение ученых относительно существования человечества шокировало общественность, вызвав бурные споры в научных кругах. Эксперты ...
Очередное мнение ученых относительно существования человечества шокировало общественность, вызвав бурные споры в научных кругах. Эксперты ...