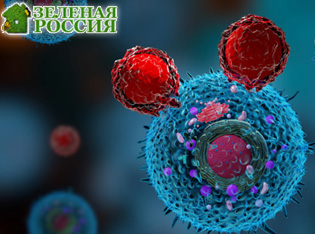
Блокировка иммунных контрольных точек (ICB) произвела революцию в лечении различных видов продвинутых раков. Однако её эффективность достигла плато из-за терапевтической устойчивости, которая делает тумор-инфильтрирующие лимфоциты (TILs) неэффективными. Поэтому поиск способов устранения этой устойчивости и восстановления антираковой активности TILs — важная цель для клиницистов в области онкологии.
Однако любое возможное вмешательство должно происходить в необычных условиях — в микросреде опухоли, почти лишённой кислорода из-за быстрого роста опухоли и плохой доставки кислорода через аномальные опухолевые сосуды. В исследовании, опубликованном в Nature Communications, доктор медицины и философии Льюис Чжичан Ши и его коллеги из Университета Алабамы в Бирмингеме впервые показывают, как HIF1α в Т-клетках играет ключевую роль в индукции интерферона гамма (IFN-γ) в гипоксической среде. Цитокин IFN-γ известен своей важностью для активации опухолево-убивающей способности Т-клеток. Кроме того, альтернатива в метаболизме, называемая гликолизом, которая позволяет клеткам человека вырабатывать энергию при отсутствии кислорода, также необходима для индукции IFN-γ в Т-клетках.
«Интересно, что при нормальном уровне кислорода в организме, называемом нормоксией, индукция IFN-γ и гликолиз в Т-клетках не регулируются HIF1α, основным регулятором гликолиза, а его широко признанным мишенью LDHa, как было показано в раннем исследовании другой группы», — сказал Ши, профессор кафедры радиационной онкологии Университета Алабамы в Бирмингеме. «Однако было неизвестно, как и в какой мере HIF1α регулирует индукцию IFN-γ и гликолиз в Т-клетках при гипоксии».
Исследователи из Университета Алабамы обнаружили, что HIF1α-гликолиз необходимы для индукции IFN-γ в гипоксических Т-клетках. HIF1α — это субъединица гипоксически-индуцируемого фактора (HIF), который играет решающую роль в координации клеточных реакций на гипоксию.
Ши и его коллеги продемонстрировали эту ключевую роль HIF1α при гипоксии, используя генетические модели мышей, анализ метаболического потока с помощью 13C-меченых глюкозных следящих анализов и анализатор Seahorse, а также фармакологические подходы.
В Т-клетках человека и мышей, активированных при гипоксии, они обнаружили, что удаление HIF1α из Т-клеток предотвращало метаболическую перестройку с катаболического метаболизма на анаболический, одним из компонентов которого является анаэробный гликолиз; удаление также подавляло индукцию IFN-γ. Кроме того, фармакологическое ингибирование гликолиза Т-клеток при гипоксии препятствовало индукции IFN-γ. Напротив, стабилизация HIF1α путём удаления его негативного регулятора увеличивала уровень IFN-γ при гипоксии.
Что касается защиты от рака, то исследователи обнаружили, что гипоксические Т-клетки, лишённые HIF1α, менее эффективно убивают опухолевые клетки in vitro. В живых организмах мыши, у которых в Т-клетках был удалён HIF1α, не реагировали на терапию с блокировкой иммунных контрольных точек (ICB).
Затем исследователи показали способ преодоления устойчивости к терапии ICB. Изучение механизма функции удаления HIF1α показало, что потеря HIF1α значительно снижает гликолитическую активность в гипоксических Т-клетках, что приводит к истощению внутриклеточного ацетил-КоА и ослаблению индукции клеточной смерти, вызванной активацией (AICD). Восстановление внутриклеточного ацетил-КоА путём добавления ацетата в среду для роста позволило восстановить AICD и вернуть производство IFN-γ в гипоксических Т-клетках с удалённым HIF1α.
Ши и его коллеги затем продемонстрировали в живых мышах, что добавление ацетата является эффективной стратегией для обхода устойчивости к терапии ICB у опухолевых мышей с специфическим удалением HIF1α в Т-клетках. Когда опухолевым мышам с удалённым HIF1α в Т-клетках давали ацетат, а затем проводили комбинированную терапию ICB, у этих мышей наблюдалось значительное улучшение результата терапии ICB, о чём свидетельствовало мощное подавление роста опухоли и значительно сниженный вес опухоли.
«TIL и опухолевые клетки используют одни и те же метаболические пути для своего роста и функции, и сосуществуют в метаболически тяжёлых опухолевых микросредах, характеризующихся гипоксией и плохим питанием, что приводит к интенсивной метаболической борьбе», — сказал Ши. «Как склонить эту метаболическую борьбу в пользу TIL, будет ключевым, и мы показали, что добавление ацетата восстанавливает производство IFN-γ в TIL с удалённым HIF1α и преодолевает устойчивость к ICB, вызванную потерей HIF1α в Т-клетках».
«Наше исследование, вместе с ранним отчётом другой группы, убедительно показывает, что нарушенная функция HIF1α в Т-клетках является основным механизмом терапевтической устойчивости к ICB, таким как анти-CTLA-4 и анти-PD-1/L1», — сказал Ши.


 Блокировка иммунных контрольных точек (ICB) произвела революцию в лечении различных видов продвинутых раков. Однако её эффективность достигла плато из-за терапевтической устойчивости, которая делает тумор-инфильтрирующие лимфоциты (TILs) неэффективными. Поэтому поиск способов устранения этой устойчивости и восстановления антираковой активности TILs — важная цель для клиницистов в области онкологии.
Блокировка иммунных контрольных точек (ICB) произвела революцию в лечении различных видов продвинутых раков. Однако её эффективность достигла плато из-за терапевтической устойчивости, которая делает тумор-инфильтрирующие лимфоциты (TILs) неэффективными. Поэтому поиск способов устранения этой устойчивости и восстановления антираковой активности TILs — важная цель для клиницистов в области онкологии. 



 Мощные антиоксиданты обеспечивают крепкое здоровье. Мы все слышали об антиоксидантах и знаем о том, что они очень хорошо влияют на наше ...
Мощные антиоксиданты обеспечивают крепкое здоровье. Мы все слышали об антиоксидантах и знаем о том, что они очень хорошо влияют на наше ... В 2015 году под Киевом планируют открыть гигантский частный зверинец по Вышгородской трассе, всего в 25 километрах от столицы. В зоопарке ...
В 2015 году под Киевом планируют открыть гигантский частный зверинец по Вышгородской трассе, всего в 25 километрах от столицы. В зоопарке ... Описанная еще Гиппократом и названная из-за нестерпимых приступов боли «капканом для ног», подагра издавна считалась болезнью сильного пола.
Описанная еще Гиппократом и названная из-за нестерпимых приступов боли «капканом для ног», подагра издавна считалась болезнью сильного пола.